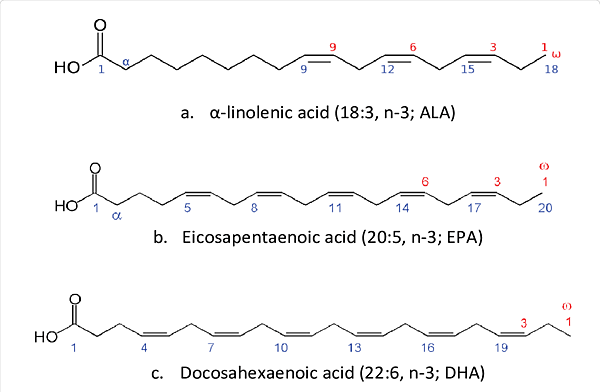
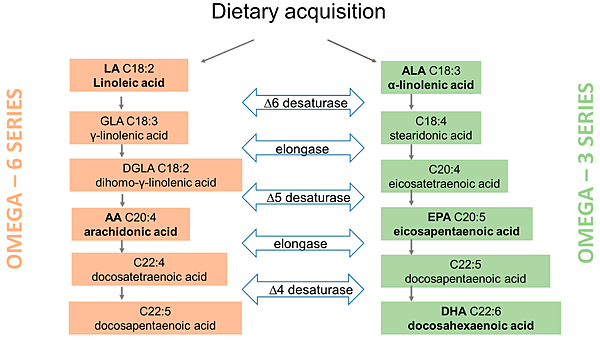
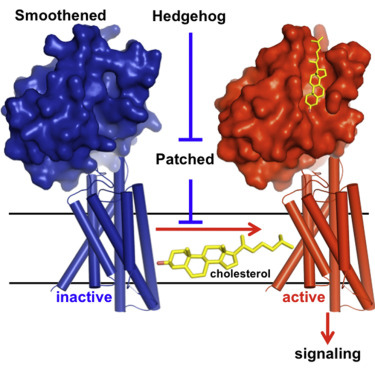
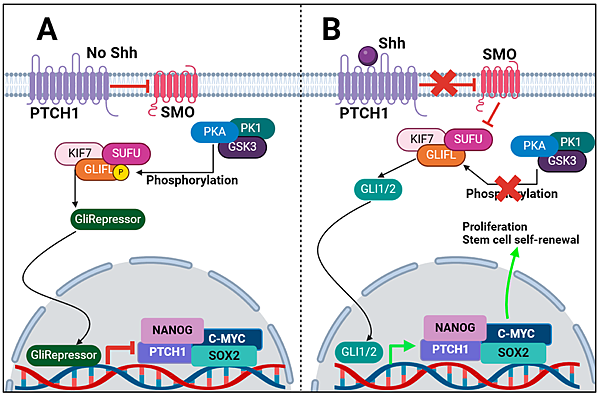
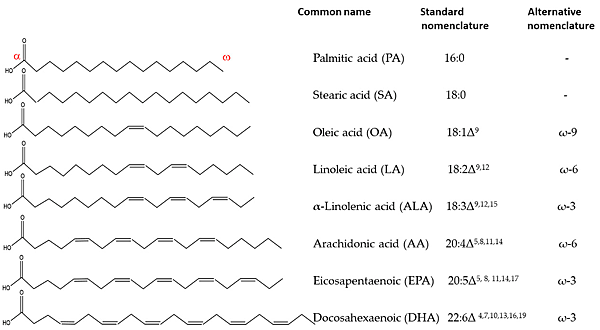
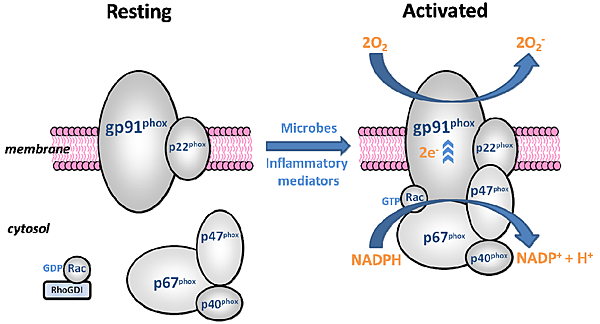
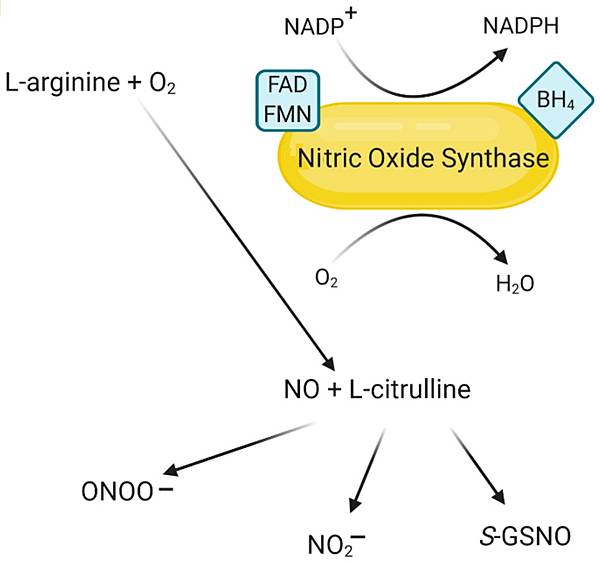
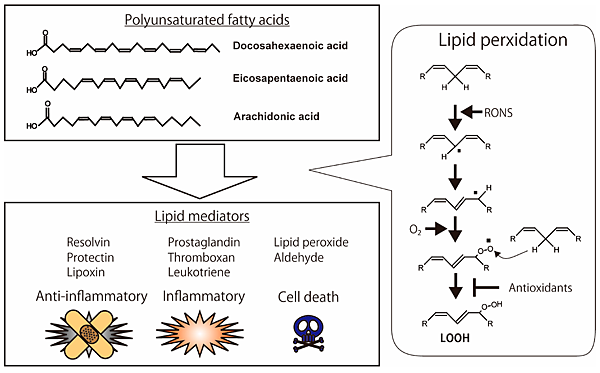
今年10月22日在Nature有一篇文章
SARS-CoV-2 mRNA vaccines sensitize tumours to immune checkpoint blockade
https://www.nature.com/articles/s41586-025-09655-y
這篇文章是回溯性的統計分析,比較「疫情前」與「疫情期間有注射新冠疫苗」的肺癌病人,使用Anti-PD-1或Anti-PD-L1治療的差異,40個月的存活率從25%提升至50%。免疫學的難懂處有如量子力學,費曼有一句名言:「I think I can safely say that nobody understands quantum mechanics.」拿到免疫學也適用。
當外來抗原入侵人體,Dendritic cell(APC)吞食外來抗原後,T cell活化前,會經過一道篩選過程,避免Autoimmune T cell活化,如下圖:
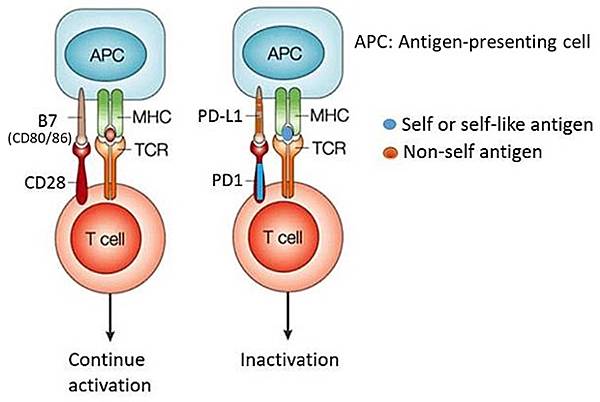
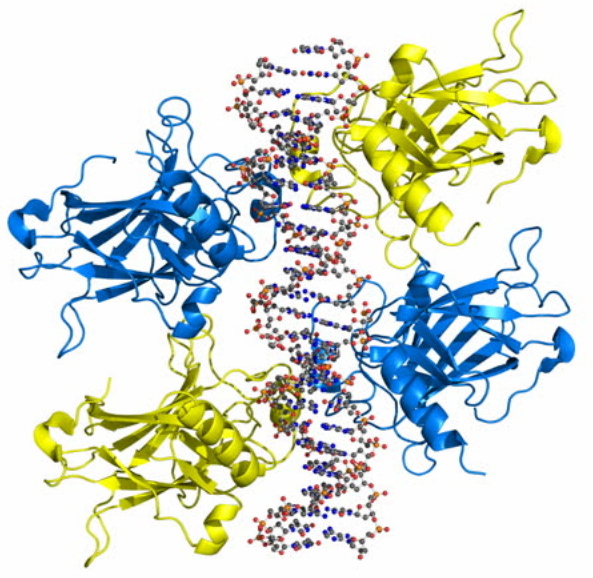
圖一:如果TCR偵測到MHC呈現的是Non-self antigen,T cell會啟動B7-CD28的刺激訊息,活化而分裂;如果TCR偵測到MHC呈現的是Self or self-like antigen,T cell 會啟動PD-1-PD-L1的抑制訊息,T cell就會停止活化。B7的另一名稱是CD80/86。Immune checkpoint blockers就是用Anti-PD-1或Anti-PD-L1 antibody重新活化被抑制的T cell,副作用是可能誘發自體免疫疾病。
癌細胞由DNA突變導致突變蛋白的Peptide被MHC-I呈現出來,如果被CD8+ T cell(CTL)辨識為Non-self antigen,CTL就會殺死該癌細胞。99.999---%的癌細胞被CTL發現後就會立即被摧毀。如果癌細胞已長成數十個或數百個,就會啟動如下的抗癌免疫機制:
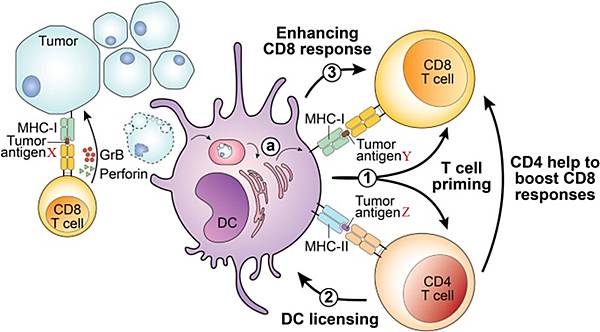
https://www.nature.com/articles/s41388-021-01946-8
圖二:某種CD8+ T cell辨識Tumor antigen X為Non-self antigen,便會殺死癌細胞。Dendritic cell(DC)吞食死亡的癌細胞,將蛋白分解處理(ⓐ),回到局部淋巴組織,把Tumor antigen Y呈現給另一種CD8+ T cell,把Tumor antigen Z呈現給一種CD4+ T cell;X、Y、Z是不同的Tumor antigen,由九個胺基酸組成的小Peptide。①---->② ---->③形成一個相互刺激的循環。CD4+ T cell會分化成Th1/Th2/Treg,Th1會分泌IL-2促使各種T cell分裂,向癌細胞移動,把癌細胞包圍起來,如下圖:
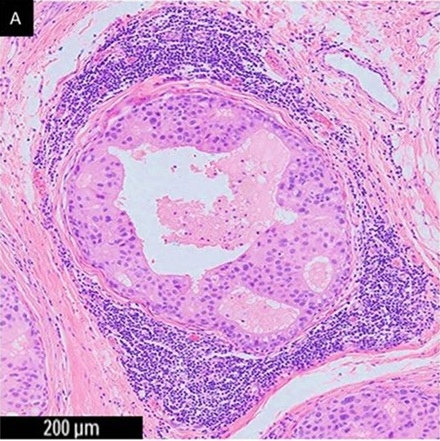
圖三:0.06公分的乳癌組織被免疫細胞(T cell、B cell、NK cell、Dendritic cell、Macrophage)包圍,Treg及Macrophage分泌TGF-b吸引Fibroblast過來分裂並產生Type I collagen將癌細胞包圍起來,使其缺乏養分供應而死亡(中心處有潰爛死亡的空洞)。99.99%以上的癌細胞一形成就直接被CD8+ T cell殺死。當數十個或數百個癌細胞長出來就會如上圖被困死,直到有一天,癌細胞經過無數次突變後不斷突破圍困,終於篩選出一個癌細胞Q,不像圖二中的癌細胞,Tumor antigens X、Y、Z可被T cell辨識成Non-self antigen;Tumor antigen Q無法被T cell辨識成Non-self antigen,這個癌細胞就會逃過免疫監控擴散出去。
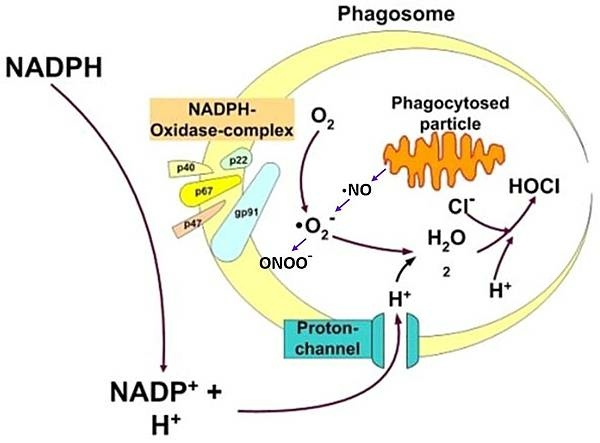
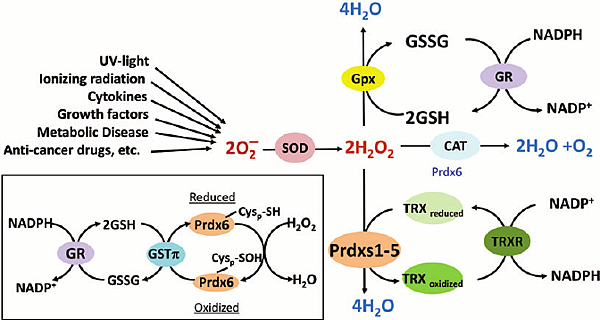
有一種情況,當圖二中的Tumor antigen X或Y所對應的CD8+ T cell會去殺死癌細胞,但也會攻擊自己的細胞(如b-islet cell),這樣的CD8+ T cell就會被Treg抑制,如下圖:
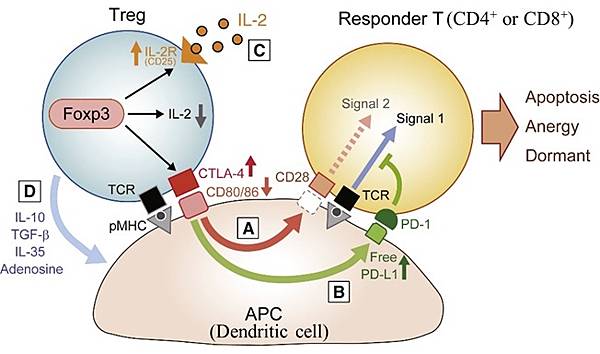
https://pubmed.ncbi.nlm.nih.gov/36917950/
SARS-CoV-2 mRNA vaccines sensitize tumours to immune checkpoint blockade
https://www.nature.com/articles/s41586-025-09655-y
這篇文章是回溯性的統計分析,比較「疫情前」與「疫情期間有注射新冠疫苗」的肺癌病人,使用Anti-PD-1或Anti-PD-L1治療的差異,40個月的存活率從25%提升至50%。免疫學的難懂處有如量子力學,費曼有一句名言:「I think I can safely say that nobody understands quantum mechanics.」拿到免疫學也適用。
當外來抗原入侵人體,Dendritic cell(APC)吞食外來抗原後,T cell活化前,會經過一道篩選過程,避免Autoimmune T cell活化,如下圖:

圖一:如果TCR偵測到MHC呈現的是Non-self antigen,T cell會啟動B7-CD28的刺激訊息,活化而分裂;如果TCR偵測到MHC呈現的是Self or self-like antigen,T cell 會啟動PD-1-PD-L1的抑制訊息,T cell就會停止活化。B7的另一名稱是CD80/86。Immune checkpoint blockers就是用Anti-PD-1或Anti-PD-L1 antibody重新活化被抑制的T cell,副作用是可能誘發自體免疫疾病。
癌細胞由DNA突變導致突變蛋白的Peptide被MHC-I呈現出來,如果被CD8+ T cell(CTL)辨識為Non-self antigen,CTL就會殺死該癌細胞。99.999---%的癌細胞被CTL發現後就會立即被摧毀。如果癌細胞已長成數十個或數百個,就會啟動如下的抗癌免疫機制:

https://www.nature.com/articles/s41388-021-01946-8
圖二:某種CD8+ T cell辨識Tumor antigen X為Non-self antigen,便會殺死癌細胞。Dendritic cell(DC)吞食死亡的癌細胞,將蛋白分解處理(ⓐ),回到局部淋巴組織,把Tumor antigen Y呈現給另一種CD8+ T cell,把Tumor antigen Z呈現給一種CD4+ T cell;X、Y、Z是不同的Tumor antigen,由九個胺基酸組成的小Peptide。①---->② ---->③形成一個相互刺激的循環。CD4+ T cell會分化成Th1/Th2/Treg,Th1會分泌IL-2促使各種T cell分裂,向癌細胞移動,把癌細胞包圍起來,如下圖:

圖三:0.06公分的乳癌組織被免疫細胞(T cell、B cell、NK cell、Dendritic cell、Macrophage)包圍,Treg及Macrophage分泌TGF-b吸引Fibroblast過來分裂並產生Type I collagen將癌細胞包圍起來,使其缺乏養分供應而死亡(中心處有潰爛死亡的空洞)。99.99%以上的癌細胞一形成就直接被CD8+ T cell殺死。當數十個或數百個癌細胞長出來就會如上圖被困死,直到有一天,癌細胞經過無數次突變後不斷突破圍困,終於篩選出一個癌細胞Q,不像圖二中的癌細胞,Tumor antigens X、Y、Z可被T cell辨識成Non-self antigen;Tumor antigen Q無法被T cell辨識成Non-self antigen,這個癌細胞就會逃過免疫監控擴散出去。
有一種情況,當圖二中的Tumor antigen X或Y所對應的CD8+ T cell會去殺死癌細胞,但也會攻擊自己的細胞(如b-islet cell),這樣的CD8+ T cell就會被Treg抑制,如下圖:

https://pubmed.ncbi.nlm.nih.gov/36917950/