1980年代初期免疫學教科書關於T cell的知識很簡單,只有Helper T cell (即Th, 或稱CD4+ T cell)及Suppressor T cell(後來改為Regulatory T cell, 即Treg);CD8+ T cell (Tc 或 CTL, 即Cytotoxic T lymphocyte) 的角色仍然撲朔迷離,原因是T cell receptor(TCR)的cDNA尚未cloned出來;TCR與MHC-I/MHC-II的配對關係當然也是全然未知。
Helper T cell (Th cell) 後來分為Th1與Th2,這觀念在1986年才被證實,當時兩者的差異在:
Th1 cell主要分泌IL-2與IFN-g
Th2 cell主要分泌IL-4與IL-5
從1980年起,Interleukin從IL-1與IL-2,數字每年增加1-2兩個,1993有了新的變化,有一個cDNA叫CTLA-8從T cell hybridoma 被篩選出來,其後被命名為IL-17,它會吸引Macrophage/Dendritic cell及Neutrophil至感染處引起發炎反應,也見於某些自體免疫疾病諸如 rheumatoid arthritis(類風濕性關節炎), psoriasis(乾癬), multiple sclerosis(多發性硬化)屬於Pro-inflammatory cytokine,但So what?Pro-inflammatory cytoines已經很多,包括IL-1, IL-6, IL-8, TNF-a, IFN-g等。
Th17觀念的建立要等到IL-23的發現(2000年),當時已知IL-23可促使已分化的Th1 cell分泌IFN-g。2003年IL-23偶然中被發現也可促使某種CD4+ T cell分泌IL-17,這種CD4+ T cell隨後被發現不同於已知的Th1與Th2,因而命名為Th17,主要分泌IL-17, IL-21, IL-22。
Th17的建立填補了Th1/Th2無法解釋的臨床現象,例如胃幽門桿菌(Helicobacter pylori, HP)感染,如果被感染的人無法清除幽門桿菌而啟動Th1/Th2 immunity,最後形成膿瘍,除了上腹不適之外,會引起發燒或全身倦怠,但幽門桿菌引起的慢性胃炎常都沒有症狀,細菌一直與胃共生存在,免疫系統卻無法清除細菌,Th17的發現可解釋這一現象。
幽門桿菌接觸上皮細胞啟動TLR(Toll-like receptor)-LPS(Lipopolysaccharide) signaling,IL-1b自上皮細胞釋出,吸引Neutrophil及Macrophage過來吞食細菌,並分泌TNF-a及IFN-g等Cytokines,另外也包括IL-6及TGF-b(兩者都可經由上皮細胞及免疫細胞分泌),我們看看下圖:

如果免疫系統無法及時清除幽門桿菌,iTreg會壓制Th1及Th2的活性,使免疫反應轉向Th17,即Macrophage吞食幽門桿菌後將抗原訊息傳給Naïve CD4+ T cell。IL-1-b + IL-6 + TGF-b促使Naïve CD4+ T cell分化為Th17 cell,IL-23(來自感染處的Macrophage)再促使Th17 cell分泌IL-17, IL-21, IL-22如下圖:

IL-17 可吸引免疫細胞(Neutrophil/Macrophage/Dendritic cell/B cell/T cell)至感染處。
IL-21 促進Plasma cell分化及抗體分泌。
IL-22 刺激上皮細胞分泌抗菌蛋白(Anti-microbiial peptides)如Defensin。
Th17 cell的活性與慢性發炎的嚴重度及疾病的症狀呈正相關。適當的Th17 活性可防止幽門桿菌入侵上皮細胞(如上圖之抗體及抗菌蛋白可驅除幽門桿菌),胃黏膜組織在胃鏡下正常,被感染的人也沒有症狀。Th17 活性若較高則會出現不等程度的慢性發炎(局部IL-1b及TNF-a量增加),甚至引發消化性潰瘍。下面是給醫學生的回覆:
1. HP 經由兩個機制影響胃酸分泌:
i) HP產生Urease將Urea分解為NH3,NH3刺激Gastrin分泌,Gastrin 可促進胃酸分泌。
ii) 發炎反應產生的IL-1b及TNF-a會抑制胃酸分泌。
HP對胃酸的淨影響是稍微降低胃酸,但也使得胃酸分泌不規則(如上所述,受NH3、IL-1b及TNF-a等因素影響),沒進食也分泌胃酸,加重發炎反應對胃黏膜的侵蝕。
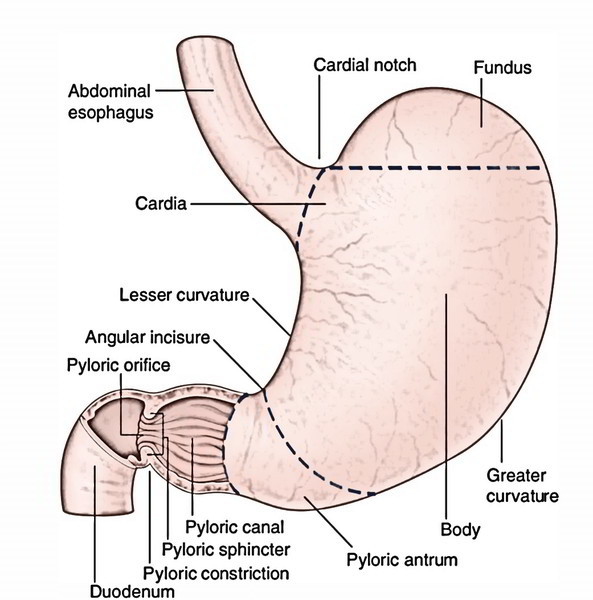
HP主要定居在幽門(Pylorus),長期HP感染,Fundus parietal cell 胃酸分泌不規則(因Cytokines + NH3),慢性胃炎會蔓延至Body及Fundus。慢性發炎時,"HP+胃酸" 加速胃上皮細胞死亡並快速分裂,到達分裂的極限(上皮細胞在人的一生中有一定的分裂次數),就會演變成Atrophic gastritis。
2. HP對Antrum的影響是直接造成慢性發炎反應,加上胃酸不按時分泌,久而久之便形成潰瘍。對Fundus的影響是胃酸不按時分泌,儘管分泌可能少一點,但不按時分泌的殺傷力不容忽視。年輕人若有HP,基本上較少發生潰瘍(Th17被Treg調整至適當的活性)。若HP合併有慢性發炎,Antrum的病變較 Fundus多。
3 HP對Antrum與Fundus的影響是同時的,對Antrum是發炎反應+不規則的胃酸分泌,對Fundus的影響是不規則的胃酸分泌。
4. HP-induced gastric ulcer 來自下列三方面的影響:
i). HP引起發炎反應(局部TNF-a增加),胃黏膜層上皮細胞死亡快速(Induced mainly by TNF-a),來不及更新就會逐漸形成潰瘍。
ii). HP產生Urease將Urea分解為NH3,NH3刺激Gastrin分泌,抑制Somatostatin分泌。Gastrin促進胃酸分泌,Somatostatin抑制胃酸分泌。
iii). 胃酸滲入正在更新的胃黏膜層上皮細胞,加速上皮細胞死亡,潰瘍慢慢形成。
幽門桿菌造成的慢性發炎可以用抗生素治療,清除幽門桿菌即可中止慢性發炎。目前已知某些Rheumatoid arthritis及Psoriasis的致病機轉與Th17活性有關,即未知的抗原訊息被Macrophage/Dendritic cell用MHC-II傳遞給Naïve CD4+ T cell,造成Th17異常活化, anti-IL-17 antibody(Secukinumab)是治療這兩種自體免疫疾病的新方法。
- Sep 15 Sun 2019 19:24
漫談免疫學-24 (Th17)
close
全站熱搜
 留言列表
留言列表
發表留言



 留言列表
留言列表
 {{ article.title }}
{{ article.title }}