68歲女性,家住南部,B型肝炎病毒帶原,肝功能一直正常,追蹤至64歲,HBs消失,且產生Anti-HBs antibody,她以為自己沒有B型肝炎了,最近四年忽略了超音波的追蹤檢查,今年五月健檢發現肝臟Caudate lobe有一個4公分的肝癌,雖然不大,但已造成肝門靜脈栓塞(Portal vein thrombosis)!
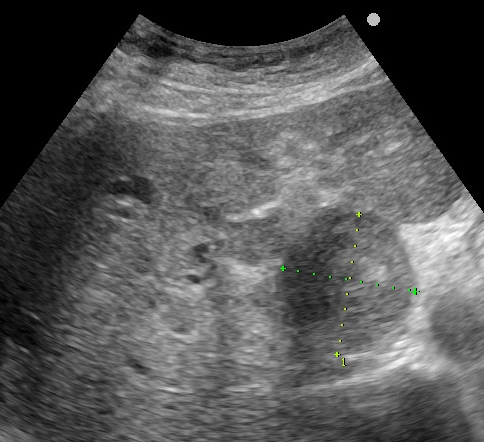
肝臟左葉Caudate lobe四公分的肝癌
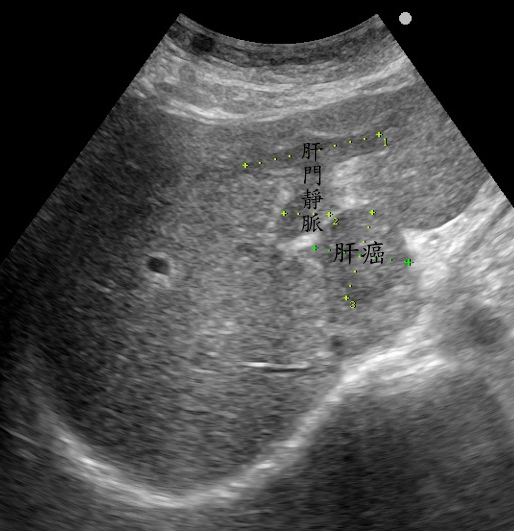
肝門靜脈進入肝臟的超音波影像顯示肝門靜脈充滿血栓
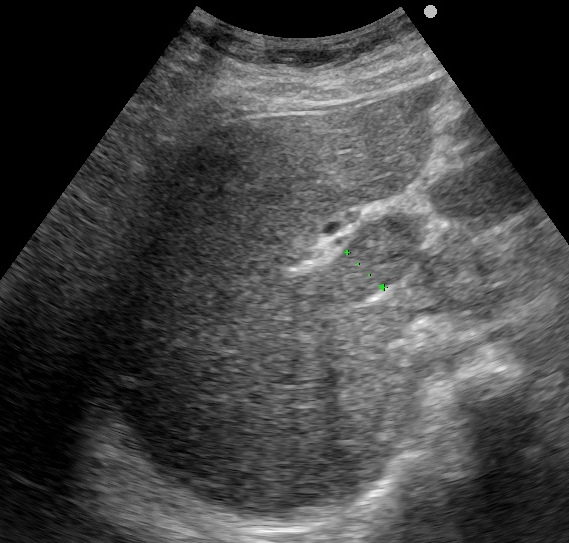
肝臟外的肝門靜脈也充滿血栓(綠色虛線標示肝門靜脈的直徑)
B型肝炎病毒(Hepatitis B virus, HBV)帶原者是B肝病毒與肝臟和平共存,ALT與AST正常,但肝癌發生率是正常人的100倍,如果是慢性肝炎(ALT常大於兩倍正常值,即80 U/L以上),肝癌發生率是正常人的500-1000倍。HBV已在上述病人肝臟存在數十年,突變效應早已發生,HBs消失與Anti-HBs產生,不代表病毒完全消失,抽血測病毒量,她的血中仍有微量病毒(26 IU/ml,小於20 IU/ml 就算測不到)。她的肝癌四公分大,但ALT/AST/GGT都正常,即使肝癌已造成Portal vein thrombosis,抽血Total bilirubin及AFP也正常(Total bilirubin 0.47 mg/dL; AFP 3.70 ng/ml)。
她因為HBs消失,anti-HBs出現,四年忽略超音波檢查,等到發現肝癌時,雖然不大,但已造成門靜脈栓塞。
Hepatitis B virus (HBV)有四個基因--S (Surface)、C(Core)、P(Polymerase)、X(X protein),製造五種蛋白HBs, HBe, HBc, HBx, Polymerase:
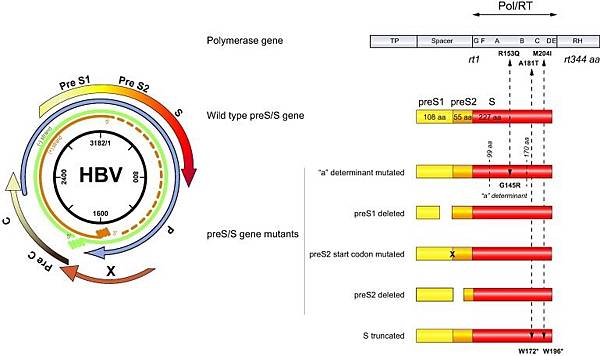
https://www.sciencedirect.com/science/article/pii/S0168827814003043
Pre-S mutant較容易產生ER stress, 肝癌發生機率是Wild type pre-S的四倍.

Hepatitis B virus 的結構如下圖:
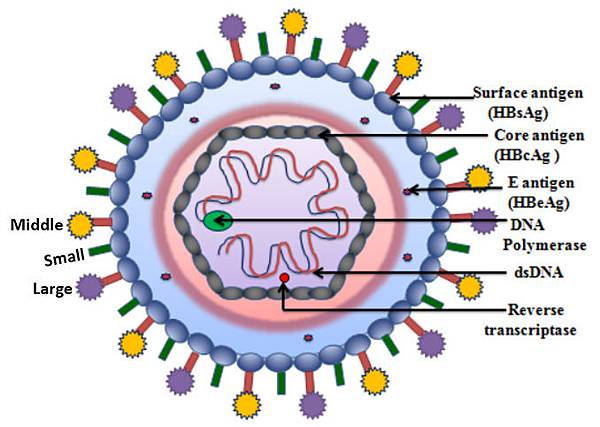
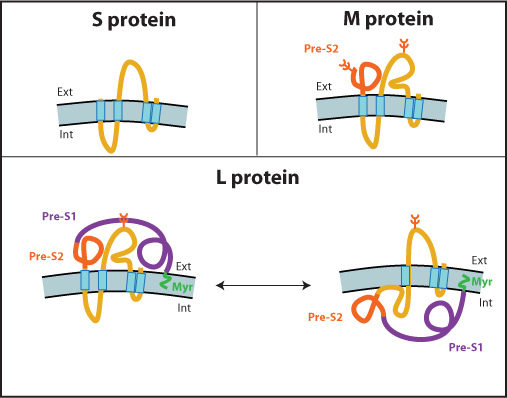
HBs(Surface antigen)有三種結構,Large (PreS1-PreS2-S ), Middle (PreS2-S), Small (S),是HBV envelope proteins:
HBV 為何會引起肝癌? 尤其是Healthy HBV carrier,肝功能始終正常,肝臟沒有慢性發炎為何罹患肝癌機會是正常人的100倍?
HBV envelope proteins (HBs large, middle, small proteins)在Endoplasmic reticulum(ER)大量累積時,會引發ER stress,也稱為Unfolded protein response (UPS)。肝細胞為了要分解Unfolded protein,就會產生過多的ROS (reactive oxygen species),DNA受ROS攻擊的機會也會增加,例如Guanine變成8-oxoguanine (8-OG),肝細胞就會產生8-oxoguanine glycosylase 1 (ogg1)來切除(8-OG),進行Nucleotide excision repair (NER)。
HBx不參與病毒結構形成,但可活化病毒核酸(cccDNA)複製/轉錄、調控肝細胞基因表現(例如Activate oncogenic PI3K/Akt signaling)、並干擾肝細胞DNA修補(bind and inhibit p53; bind and inhibit proteins for nucleotide excision repair ),如下圖:
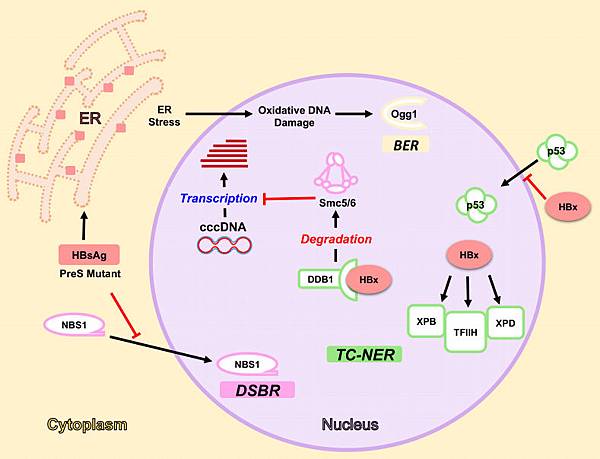
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5691655/
1. HBx與p53結合,抑制p53對DNA突變的反應。當CD8+ T cell 發現肝細胞MHC-I分子表現HBV peptide而攻擊肝細胞(慢性肝炎的病因),肝細胞死亡後再生需要p53調控G1 phase,若DNA有突變,p53可引發G1 arrest,先修補DNA再讓Cell cycle通過G1 phase。
2. HBV envelope proteins (Large, Middle, Small HBs) 尤其是PreS2 mutant會誘發ER stress,肝細胞會因ROS累積過多而增加DNA的突變機率。DNA若發生突變,需要Nucleotide excision repair(NER)來修補,HBx與NER的蛋白(XPB, XPD, TFIIH)結合,干擾Transcription-coupled (TC)-NER。
3. ROS若造成DNA double strand break (DSB),肝細胞會誘導DSB repair (DSBR),PreS 及其mutant會抑制DSBR 的MRE11–RAD50–NBS1 (MRN) complex 形成。
4. SMC5/6參與多項染色體結構/分離及DNA複製/修補的功能,若與B肝病毒的cccDNA結合,會抑制cccDNA的Transcription。HBx與DDB1-Cul4 complex(E3 ligase)結合,促使SMC5/6進入Ubiquitin-proteasome degradation pathway分解,B肝病毒的cccDNA就可順利進行Transcription。
肝癌會產生哪些基因的突變?如下圖,hTERT promoter機率最高(47.1%),其次是p53(28%-36%),再其次是Wnt-b-catenin signaling(17-37%)。
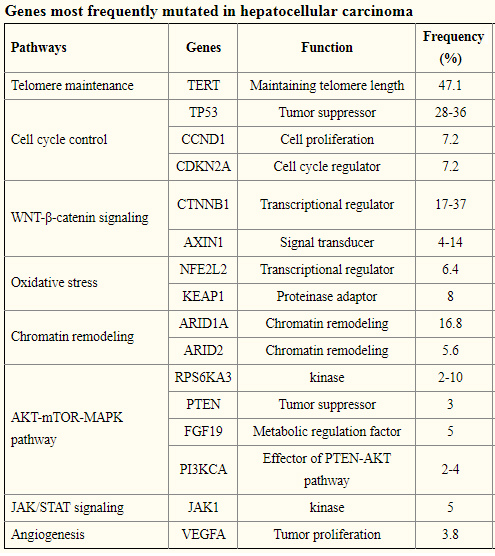
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5589693/
Wnt-b-catenin signaling活化後會促進PI3K/Akt/mTOR signaling。
p53突變喪失G1 arrest功能後,肝細胞累積突變會加速。
以上兩者是各種腫瘤最重要的Driver mutation。
hTERT promoter DNA的早期幾個突變通常是抑制hTERT(human telomere reverse transcriptase--即Telomerase)的Transcription,hTERT不足,肝細胞Telomere會縮短,兩條Chromosome發生異常接合或斷裂的機會增加;到了晚期,hTERT promoter DNA增加的突變則是促進hTERT的Transcription,產生足夠的 hTERT,此時癌細胞持續快速分裂,但Telomere可以維持穩定的長度,不會因快速分裂而縮短。
Telomere是染色體末端長約3-20 Kb的TTAGGG repeat,細胞每次分裂會損失100 base pair,要靠hTERT(Telomerase)補回來。Telomere結構如下圖:
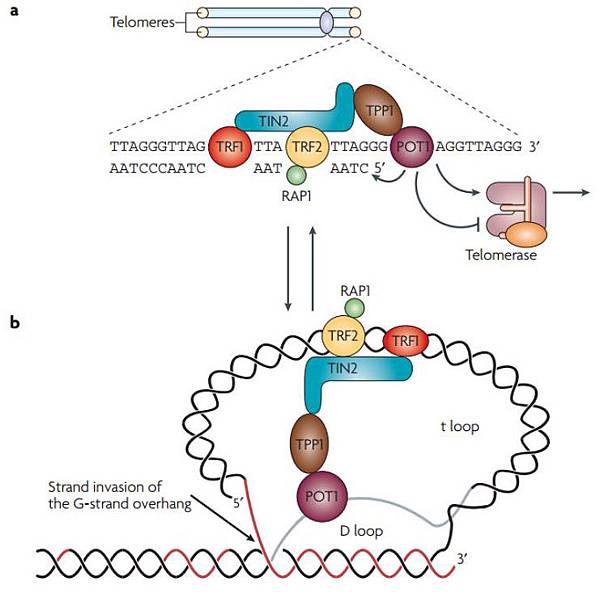
Telomere (TTAGGG)n 在染色體末端形成D loop及t loop,並由Telomere-binding protein(TRF1, TRF2)保護,防止DNA自發性水解。Telomere縮短到ㄧ定程度,細胞就會走向老化死亡。
https://www.nature.com/articles/nrc2393



 留言列表
留言列表
 {{ article.title }}
{{ article.title }}