現在臨床上使用的治療性抗體(Therapeutic antibody)以Human及Humanized antibody為主,Mouse 及Chimeric antibody仍有但會被漸漸淘汰。1986年上市的anti-CD3 antibody (Muromonab-CD3),用於對抗器官移植的排斥作用,是Mouse monoclonal antibody;1997年上市的anti-CD20 antibody (Rituximab),用於治療 Non-Hodgkin's lymphoma,是Chimeric mouse-human antibody。1998年以後,美國FDA核准上市的Therapeutic antibody以Humanized antibody為主,現在的趨勢則是以Phage antibody library篩選Purely human antibody。
有醫學生問到「Humanized antibody」,到底Humanized antibody 與Human antibody是怎樣造成的差異?
關於Chimeric antibody, humanized antibody, human antibody 如果沒有好的生化基礎及分子生物的實戰經驗,絕對看不懂Textbook及Review article在寫些甚麼,卷哥卷姊恐怕也是讀天書,霧煞煞。
下圖顯示Therapeutic antibody的演變:
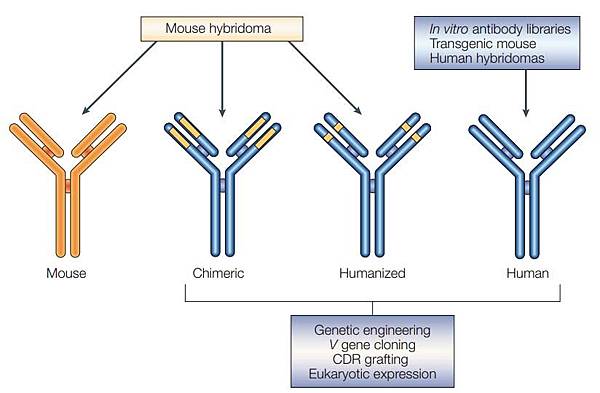
圖一:治療性抗體之演變,土黃色區域來自Mouse monoclonal antibody,藍色區域是Human antibody 的成份。
Mouse antibody 即Monoclonal antibody,是小鼠經抗原(antigen)刺激後,取出脾臟的淋巴細胞與骨髓瘤細胞(Myeloma cell)融合後,形成融合瘤(Hybridoma),再從融合瘤細胞篩選出由單一細胞長出來(Single colony)能產生抗體對抗antigen的一群細胞,如下圖:

圖二:Monoclonal antibody 的製造流程
Mouse monoclonal antibody不適合用來做為Therapeutic antibody,因為打進人體後,人體會產生Anti-mouse IgG antibody。其實Monoclonal antibody最重要的部分是與抗原結合的CDR(Complementary determinant region),如下圖CDR1/CDR2/CDR3:

圖三:抗體的立體結構及CDR位置。CDR1=L1+H1; CDR2=L2+H2; CDR3=L3+H3。
L=Light chain; H=Heavy chain
欲製造Humanized antibody,只要把Mouse hybridoma cell製造抗體的基因定序,找出CDRs~即Heavy chain及Light chain上CDR1/CDR2/CDR3的cDNA片段(每一個CDR約10~ amino acid, 相當於30~ base pairs in cDNA),並將六個CDR的DNA序列(A T C G)合成出來,接進人類抗體基因(Human immunoglobulin genes)相對應的Heavy chain及Light chain cDNA上的CDR1/CDR2/CDR3位置,換句話說,就是用小鼠抗體的CDR1/CDR2/CDR3 cDNA置換人類抗體的CDR1/CDR2/CDR3 cDNA(人類抗體的CDR1/CDR2/CDR3 cDNA被刪掉)。經置換過的human IgG heavy chain cDNA與human IgG light chain cDNA,分別接在兩個Expression vectors,如下圖:
圖四:Humanized antibody的製造流程。紅藍黃三色標示Mouse hybridoma cell immunoglobulin heavy chain and light chain CDRs。
如圖四,將Plasmid 1與Plasmid 2 一起送進CHO cell (Chinese hamster ovary cell),然後用G418 (Neo) + Hygromycin (Hyg) 兩種抗生素篩選抗藥性的CHO cell,G418會強迫Plasmid 1 進入CHO cell 的Genome,Hygromycin會強迫Plasmid 2進入CHO cell 的Genome。然後將CHO cells養成數百個Single colony,從中篩選會分泌抗體的Single colony (抗藥性的CHO cells)。此處使用CHO cell來製造抗體,Plasmid 1及Plasmid 2 上有特殊Promoter可驅動Heavy chain及Light chain表現,因此不需要B cell或Hybridoma cell就能製造出大量且品質一致的抗體。
Chimeric antibody則是擷取Mouse monoclonal antibody中的 VL 及VH,把Mouse VL-Human CL cDNA接起來,再把Mouse VH-Human CH cDNA接起來,Mouse VL 及VH包含CDR1/CDR2/CDR3,但這種Chimeric antibody擷取太多Mouse monoclonal antibody的成份,如下圖:

圖五:Chimeric antibody的製造流程與Humanized antibody類似
Human therapeutic antibody怎麼做出來的?有兩種方式:
1. 將小鼠的抗體Heavy chain 及Light chain基因都Knockout,然後把人類抗體Heavy chain 及Light chain基因植入小鼠的Genome,再篩選適合製造Human monoclonal antibody的小鼠,製造方式如圖二。
2. Phage antibody display library如下圖六,將人類抗體Fab fragment的兩段cDNA植入M13 Phage genome。Heavy chain與Light chain各有三個CDR,若每個CDR由10個amino acid組成,則每個CDR至少有2010種胺基酸組合,Fab fragment有六個CDR,因此有6 x 2010種胺基酸組合。操作方式是以M13 phage genome為template在CDRs進行隨機突變,CDR胺基酸組合數代表Library的大小,Library 越大,越能篩到想要的抗體:

圖六:人類抗體Fab fragment表現於HuCal phage (M13 phage的衍生Phage)

圖七:Phage antibody display。
如上圖,將抗原蛋白固定在試管壁,Phage library通過試管後,把與抗原蛋白結合的Phage挑出來用E coli 培養,反覆篩選出與抗原結合力最強的Phage,然後將Phage genome 上的兩個Fab cDNA(Light chain 及Heavy chain-Fab)切下來,其中Heavy chain-Fab接上Fc cDNA就是Full-length heavy chain cDNA。有了Heavy chain 及Light chain cDNA,就可用 "圖四" 的流程製造Human antibody。今年諾貝爾化學獎其中之一就是發展出Phage display library的科學家 Gregory Winter 與 George Smith。現在製造Therapeutic human antibody可以不使用動物及Hybridoma cell,只需Phage antibody library及Cell line (CHO cell, NS0 cell, Sp2/0 cell等),加上基本的分子生物學技術,就能製造Human antibody against a target antigen to achieve a presumed therapeutic effect.



 留言列表
留言列表
 {{ article.title }}
{{ article.title }}